章也 1 ,李東陽 1 ,李益民 1 ,羅豐華 1 ,舒暢 2 ,李松 1
(1. 中南大學 粉末冶金國家重點實驗室,長沙 410083;2. 中南大學 湘雅二醫院血管外科,長沙 410011)
摘 要: 作為生物可降解材料,Fe-Mn 合金具備良好的力學性能和生物相容性,受到廣泛關注。本文采用注射成 形制備了Fe-xMn (x=25,30,35,質量分數,下同)合金,研究了燒結時間對 Fe-Mn 合金顯微組織、力學性能和體外靜態降解性能的影響。研究表明:燒結時間對 Fe-Mn 合金相組成無明顯影響,而 Mn 含量影響合金的相組成,Fe-35Mn 合金主要由奧氏體組成。所制備注射成形Fe-Mn合金平均晶粒度約為 10~20μm,表面Mn損失約為5.8%~10.82%。燒結時間為7 h 時,Fe-35Mn 合金力學性能最佳,拉伸斷裂強度達到 358 MPa,伸長率為10.83%,30 天靜態浸泡降解試驗顯示,該合金浸泡一天降解速率為1 mm/y,且隨腐蝕產物堆積而逐漸降低。
關鍵詞: 注射成形;生物可降解合金; Fe-Mn 合金;力學性能;降解性能
中圖分類號: R318.08 文獻標志碼: A
近年來,可降解金屬材料在骨科[1]、顱面植入[2] 和心血管支架[3]等生物醫學領域的應用迅速增加,有望代替傳統的永久性材料,如:不銹鋼、鎳鈦合金、鈷鉻合金,解決植入物長存體內引發的各種不良組織反應。目前,鎂基[4]、鐵基[5]和鋅基[3, 6]合金是研究較為廣泛的可降解材料。與鎂基和鋅基合金相比,鐵基合金具備更優異的綜合力學性能,如高的強度、良好的延展性和成形性,一方面能增加植入體的力學可靠性,另一方面可減少植入金屬用量,減緩降解產物對人體帶來的負擔。但鐵及其合金降解速率過低,比如,純鐵在 Hank’s 溶液中降解速率僅為 0.008~0.16mm/y,很長時間難以體內降解。因此,如何有效提高其降解速率是可降解鐵合金的研究重點[7]。合金化是解決這一問題的有效途徑之一,通過添加 Mn、W、S、Pd等合金元素,可在較寬范圍內有效調控降解速率(0.145~25.10 mm/y)[8−9]。其中 Mn是比較合適的添加元素,在人體代謝中,Mn參與氨基酸、蛋白質和碳水化合物的代謝過程,在免疫系統的運行、能量的調節和組織的生長、凝血過程中扮演著重要角色。研究表明,就 Fe-Mn 基合金在體液中的降解而言,Mn的釋放量遠低于其在血液中的毒性水平,逐漸釋放的 Mn 也能被機體合理代謝[10]。與此同時,Mn 的電極電位低于Fe,兩者結合形成的 Fe-Mn 無限固溶體具有更高的腐蝕電勢[8]。當w(Mn)高于29%時, Fe-Mn 合金形成單一的奧氏體相,可以提高核磁共振兼容性[11]。HERMAWAN等[12]率先報道了Fe-Mn合金作為生物可 降解材料的可行性。研究發現,Fe-35Mn 合金降解速率提升至0.52 mm/y,力學性能與316L不銹鋼相當,然而其降解速率仍然遠遜于鎂合金。
目前報道的可降解 Fe-Mn合金大多使用粉末冶金[13− 14]、鑄造[15− 16]、鍛造[17]等傳統的加工制造工藝獲得,而制備植入體等細小精密產品時往往需要配合較多后續機加工工序,不利于產品工業化生產。金屬注射成形[18− 19]技術作為新型的精細零部件制備技術,已經成功應用于較多材料體系的制備,有望成為生物植入體等醫療產品及器械的制造技術首選,但目前尚未有注射成形Fe-Mn可降解合金的相關研究報道。本文利用注射成形技術制備Fe-xMn (x=25 、30 、35)合金,研究了燒結時間對合金成分變化、顯微組織、力學性能以及靜態降解性能的影響,為后續注射成形制備可降解 Fe-Mn 生物結構元件提供理論依據。
1.實驗
實驗所用預合金Fe-50Mn粉末由湖南恒基粉末有限公司提供,通過添加羰基鐵粉可以得到不同 Mn 含量的 Fe-25Mn、Fe-30Mn 和 Fe-35Mn 混合粉末
將上述混合均勻的粉末與多組分粘結劑(60%石蠟+36.5%高密度聚乙烯+3.5%硬脂酸)在密煉機中混煉3h,其中金屬粉末裝載量(體積分數φ,下同)為 58%。隨后經過造粒、注射得到標準德拉伸樣生坯,最后通過溶劑脫脂(二氯甲烷、40℃、8 h)和熱脫脂(氬氣、600℃、1 h)兩步脫脂法去除粘結劑。考慮到 Mn 的熔點為1 244℃,參照以往的研究[20−21],將燒結溫度設置為1200 ℃,分別燒結4、7 和 10 h,爐內真空度保持在10−1 Pa。
根據 ASTMB962- 13標準,采用阿基米德排水法進行燒結坯密度測試,樣品經過線切割,碳化硅砂紙 (180-2000#)逐級打磨,氧化硅熱解懸浮液拋光后測試。 錳含量用化學滴定法測試。碳含量和氧含量分別通過CS-600 碳硫分析儀和TCH-600氧碳氫分析儀測得。顯微組織通過掃描電子顯微鏡(SEM, Quanta FEG 250, USA)和電子背散射衍射(EBSD, FEI Helios Nanolab G3 UC, USA)觀察。相組成通過X射線衍射儀(XRD,D8 Advance, Japan)進行測定。室溫力學拉伸試驗在電子萬能材料試驗機(Model 3369, USA)上進行,拉伸速度2.0 mm/min,拉伸試樣標尺距離為50 mm,結果取 三個平行試樣的平均值。
體外浸泡實驗參照ASTM-G31-72標準 ,在 (37±0.5) ℃恒溫培養箱中進行。將 Fe-35Mn 合金切割成 10 mm×10 mm×5 mm 塊狀樣品,各面經過 180~2000#砂紙逐級打磨,用蒸餾水、無水乙醇逐次清洗烘干。樣品浸泡在 Hank’s 人工模擬體液中,樣品表面積與浸泡溶液體積比為 1 cm2:30 mL。浸泡溶液每兩天更換一次,靜態浸泡1、3、7 、15 和 30 天后取出,用混合溶液(20 g (CN4)2HC6H5O7+100 mL H2O) 在 80 ℃水浴加熱20 min 去除試樣表面沉積的腐蝕產物,隨后用乙醇超聲清洗烘干,根據下式計算腐蝕速率:
CR=8.76×104 W (1)
ATP
式中: W為質量損失,g;A 為腐蝕表面積,cm2;
t 為腐蝕時間,h;ρ 為樣品密度,g/cm3。
2 結果與討論
2.1 雜質和密度
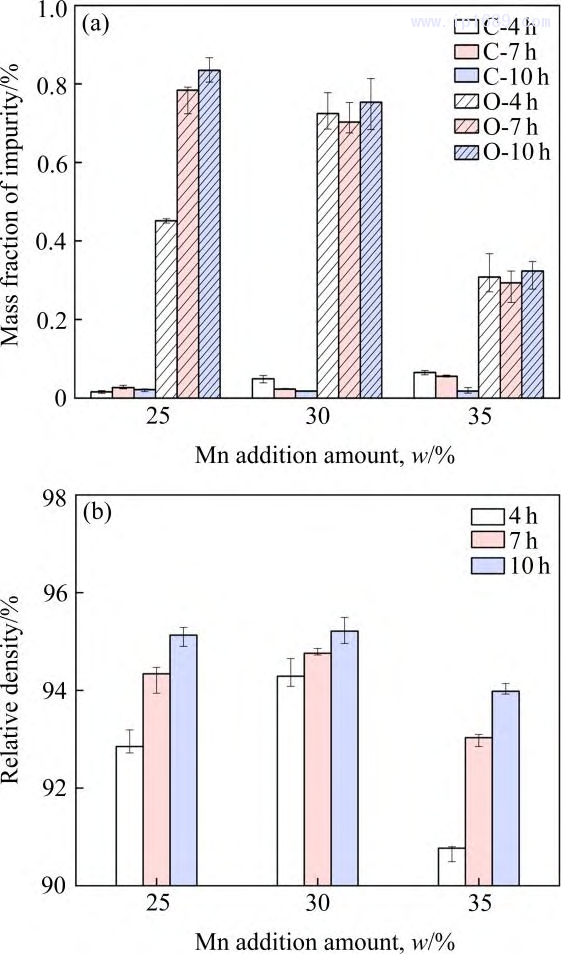
圖1(a)為不同燒結時間下Fe-Mn 合金實際碳含量和氧含量。碳含量均低于0.1%,說明粘結劑基本脫除。相同的燒結時間下,碳含量隨著Mn含量的增加略有增加,氧含量則相反。在燒結過程中,碳與氧結合,生成CO 或CO2,隨著碳含量的增加,氧含量逐漸降低,因此,Fe-35Mn合金氧含量維持在較低的水平。而過高的氧含量會損害合金的力學性能[22]。圖1(b)為不同燒結時間下Fe-Mn 合金的致密度。合金的密度隨著燒結保溫時間的延長逐漸增加,隨著Mn 含量的增加先增加后下降,其中Fe-30Mn 合金的密度最大,這可能與Mn原子的擴散速率變化有關。研究表明[23−24] Mn的擴散系數隨著Mn含量的增加先增大后減小,較大的擴散系數可提高合金燒結活性,加速晶粒長大,因此合金的氣孔和晶界逐漸減少,樣品的總體積收縮,密度增加。
圖 1 不同燒結時間 Fe-Mn 合金雜質含量(a)和致密度(b)
2.2 Mn 的損失
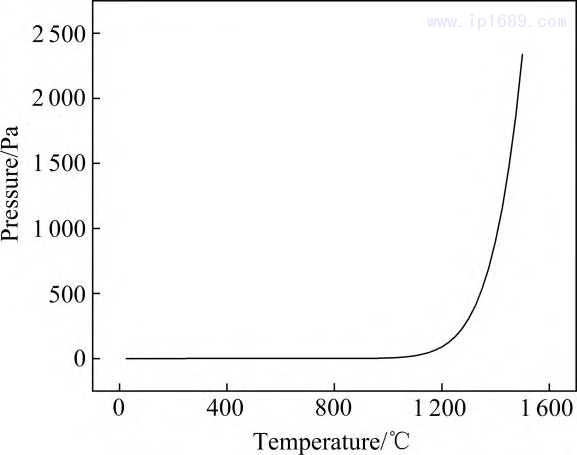
錳在真空環境下容易揮發和氧化,很大程度上影響了高質量鐵錳合金的制備和利用[25]。溫度和壓力會影響Mn的揮發程度,Mn 的平衡蒸汽壓隨溫度的變化曲線如圖 2 所示。可以看出,1100 ℃以下蒸汽壓極低且變化不大,降低燒結溫度可以減少揮發,但過低的溫 度不利于燒結致密化。 1200℃時Mn的平衡蒸汽壓為1.55 Pa,高于1200℃后蒸汽壓急劇上升,因此,本研究以 1200℃作為燒結溫度。燒結過程中真空度為10−1Pa,爐內壓力小于Mn 的平衡蒸汽壓,顯然不可避免存在 Mn 的揮發[26]。
圖 2 Mn 的平衡蒸汽壓隨溫度變化曲線
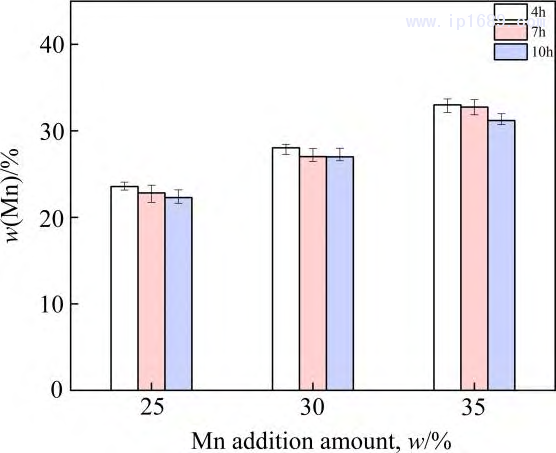
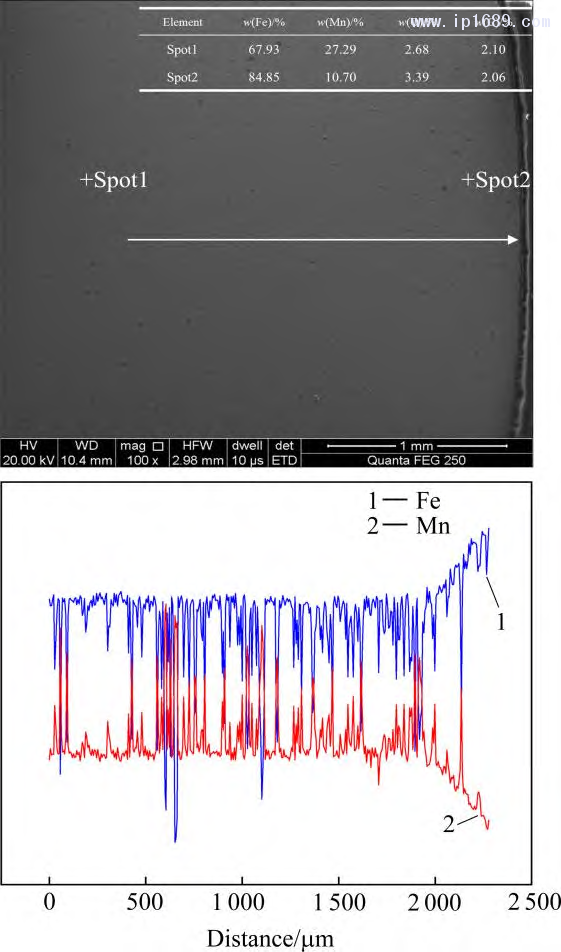
保溫時間越長,Mn 的揮發越嚴重,而Fe的揮發相對于Mn的揮發可以忽略不計[27]。圖3為不同燒結時間下Fe-Mn 合金中Mn含量。隨著燒結時間的延長,Mn的損失逐漸增加,燒結4 、7和10h 后相比于名義成分Mn 的平均收得率分別為94.2%、92.14%和 89.18%。圖4為燒結7 h Fe-30Mn合金的SEM 圖像和線掃描圖。 Mn的平均質量分數在25%~28%之間,進一步證實Mn的揮發,靠近試樣表面 300~400μm 的區域內,Mn 的含量急劇下降。過多Mn 的揮發會改變合金實際成分與相組成,也對真空燒結設備帶來污染。因此,必須從兩方面來控制Mn的揮發。一方面,需要合理設計燒結溫度,調控爐內壓力,保證爐內壓力大于燒結溫度下Mn 的平衡蒸汽壓,從而抑制 Mn 的揮發。另一方面,可以根據燒結保溫時間與Mn的收得率之間的關系,保證合金Mn含量與燒結保溫時間的平衡。
圖3 燒結時間和Mn添加量對Fe-Mn合金中Mn的影響
圖4 燒結 7 h Fe-30Mn 合金 SEM 圖像和線掃描分析
2.3 XRD 與 SEM 分析
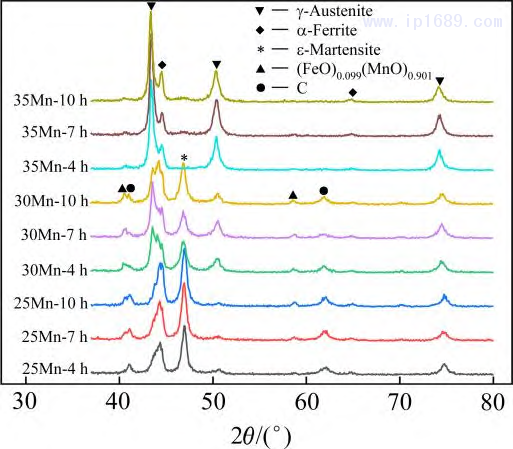
圖5為不同燒結時間下Fe-Mn合金的XRD圖譜。可以看出,燒結時間對 Fe-Mn 合金的相組成無明顯影響,而 Mn含量會影響合金相組成和衍射峰的位置。Fe-25Mn 和 Fe-30Mn 合金主要由奧氏體、鐵素體和馬氏體相組成,但隨著Mn含量的增加,奧氏體含量相對增加, 鐵素體和馬氏體含量減少。其中,Fe-35Mn 合金主要由奧氏體組成,少量-Fe 相的存在可能與局部成分不均勻有關[20]。此外,隨著Mn含量的增加,應奧氏體的衍射峰向左偏移,這是由于Mn在鐵基體 中的固溶量增加,奧氏體晶格常數增大所致。由于Fe和Mn都易氧化,因此在圖中均存在對應氧化物的衍射峰,并且隨著Mn含量的增加,氧含量逐漸降低,氧化物衍射峰逐漸減弱。
圖 5 不同燒結時間 Fe-Mn 合金的 XRD 圖譜
圖6為燒結7 h Fe-Mn 合金的SEM 圖像和能譜分析數據。通過EDS能譜分析可以看出,相比于名義成分,基體的錳含量有一定的損失。基體中彌散分布著一定量的雜質相,Fe-25Mn 和 Fe-30Mn 合金的雜質相大多為錳的氧化物,而Fe-35Mn 合金的雜質相主要以鐵的氧化物為主,并且隨著Mn 含量的增加,氧化物逐漸減少,這與XRD結果相一致。
2.4 晶粒尺寸分析
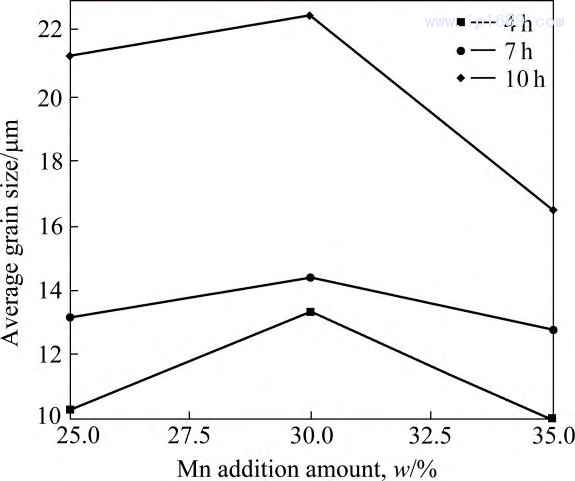
圖7為不同燒結時間下Fe-Mn合金的晶粒分布圖,可以明顯看到,所有合金的晶粒尺寸較為均勻,且隨著燒結保溫時間的延長而逐漸增大。圖8為不同 燒結時間下Fe-Mn合金的平均晶粒尺寸,合金晶粒尺寸隨 Mn 含量的增加先增加后下降,Fe-30Mn 合金的晶粒尺寸最大,這與Mn的擴散系數變化規律一致。
Mn 含量相同的情況下, 隨著燒結保溫時間的延長, 晶粒逐漸長大。
圖 7 不同燒結時間 Fe-Mn 合金的晶粒分布圖
圖 8 不同燒結時間 Fe-Mn 合金平均晶粒尺寸
2.5 室溫拉伸力學性能
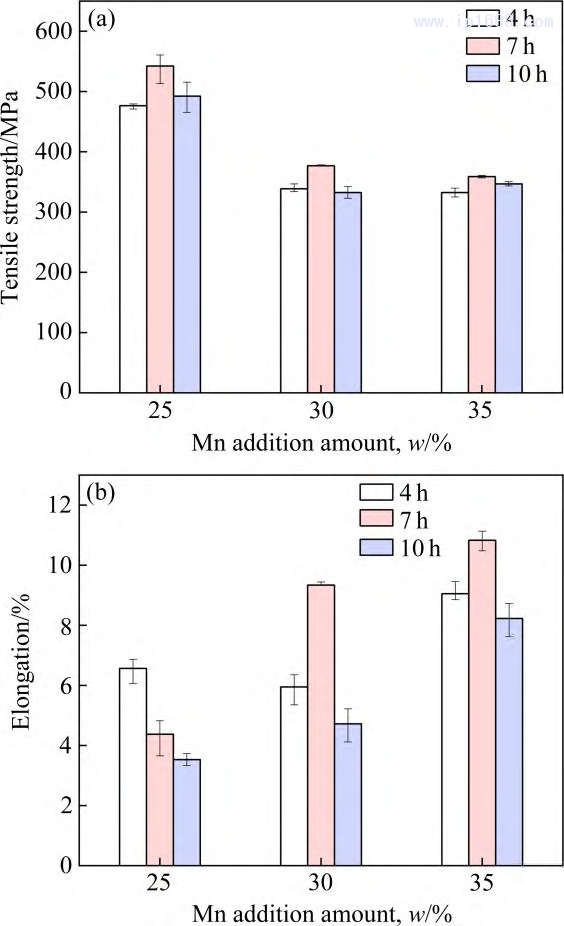
圖9為不同燒結時間Fe-M下合金的室溫拉伸力學性能。其中抗拉強度如圖 9(a)所示,三種 Fe-Mn 合金均在燒結7h后獲得最高抗拉強度。如前所述,Fe-25Mn、Fe-30Mn、Fe-35Mn 隨著燒結時間由4h延長至10h,致密度分別由92.85%、94.29%、90.77%提升至95.13%、95.21%、93.98%,孔隙的減少雖有利于抗拉強度的提高。但平均晶粒度的大幅提高(圖8) ,導致細晶強化機制減弱,從而使合金的抗拉強度降低。
相同的燒結時間,隨著Mn含量的增加,合金的抗拉強度逐漸下降。
研究發現Fe-Mn 合金中Mn含量的提高會降低彈 性模量, 提高塑性[28]。如圖9(b)所示, 合金伸長率整體上隨Mn含量增加而逐漸增加。對三種 Fe-Mn 合金而言,當燒結時間為7 h 時,Fe-30Mn 和Fe-35Mn合金不僅擁有最高的抗拉強度,其伸長率也最高,而對于Fe-25Mn 合金,燒結7 h的伸長率相較與4 h要差,可能與其雜質氧含量的成倍增長有關,過高的氧含量 會導致合金的脆性增加[29]。
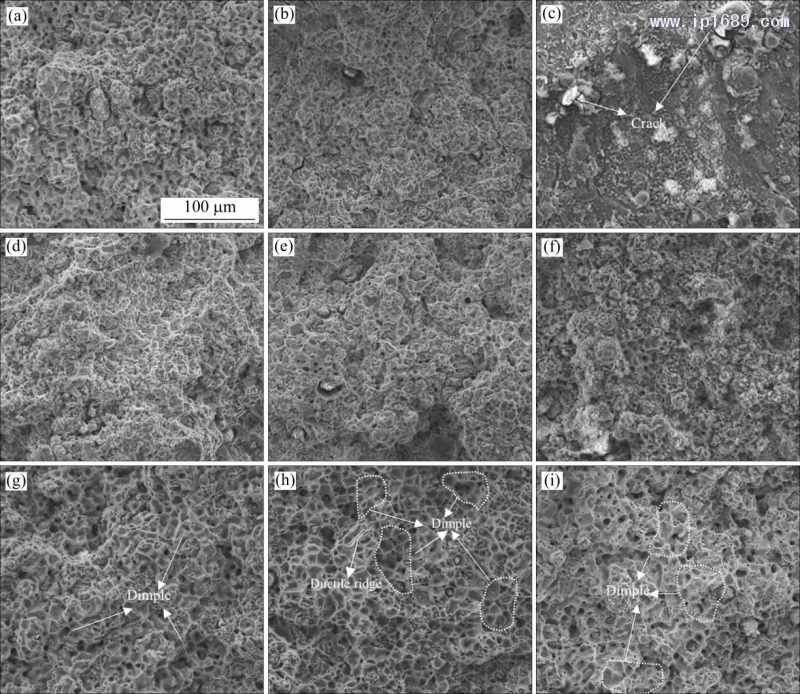
圖 10 為不同燒結時間 Fe-Mn 合金室溫拉伸斷口形貌圖。相同的燒結時間,隨Mn含量的增加,合金 的韌窩數量增多,韌性更好。Fe-35Mn合金斷口均表現出大而多的韌窩(圖 10(g)~(i))。Mn 含量相同時,隨著燒結時間的延長,三種 Fe-Mn 合金的塑性先升高后降低,其中,Fe-25Mn 合金燒結10h斷口表現為韌−脆過渡斷裂特征,可以清楚地看到準解離斷裂形貌,并且伴隨著裂紋的產生(圖10(c))。燒結7 h的 Fe-35Mn合金顯示出大量的塑性脊和較大的韌窩(圖10(h)),塑性相對最好,與圖9(b)一致。
本研究通過注射成形制備的Fe-Mn合金在抗拉強度方面滿足了臨床上對可降解血管支架材料的要求,抗拉強度大于300 MPa,但伸長率低于15%,與同成分通過熔煉法制備的Fe-Mn 降解合金存在差距[30],主要原因在于不能完全消除的孔隙和較高的碳氧雜質。金屬注射成形可降解 Fe-Mn 合金的開發,有利于實現復雜微細零部件、植入體的精確快速制備,但是需要對成分設計、原材料制備、雜質控制等方面進一步開展研究,提高產品綜合力學性能。
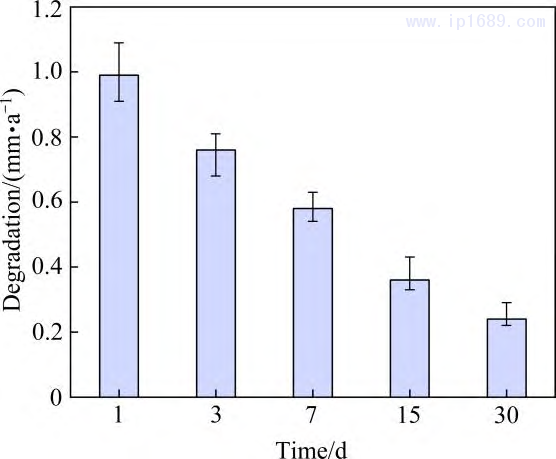
金進行靜態浸泡降解性能研究。圖11 為燒結7hFe-35Mn 合金的降解速率隨浸泡時間的變化。可以看出,隨著浸泡時間的延長,合金的降解速率逐漸下降,與其它靜態浸泡測試實驗現象相似,歸因于表層腐蝕 產物的堆積[14, 31]。圖12為降解15天合金表面微觀組織形貌圖,點掃描分析顯示表面覆蓋物以氧化物和磷酸鹽為主。鐵的降解速率為0.008~0.036 mm/y,其降解速率與永久支架無異[7]。本研究中Fe-35Mn 合金浸泡一天時降解速率可以達到1 mm/y,高于純鐵和大部分鐵基合金。本研究制備的Fe-Mn進一步拉近了鐵合金與鎂合金的降解周期,有望在12~24月實現完全降解。
圖 10 不同燒結時間 Fe-Mn 合金室溫拉伸斷口形貌
圖11 Fe-35Mn-7h合金的降解速率隨浸泡時間變化 圖 12 Fe-35Mn-7h 合金浸泡 15天表面組織形貌圖
除成份外,降解速率受晶粒尺寸、雜質含量、孔隙率以及降解環境影響較大。研究表明[32]晶粒越細小均勻,相對晶界密度越高, 晶粒內部與晶界之間所形成的微電偶腐蝕能增加降解速率。雜質含量偏高,帶來的雜質相也有類似的效應[33]。孔隙率也是影響合金降解速率的重要因素,額外的孔隙會增加合金在腐蝕環境中的暴露面積,提高降解速率[31]。研究報道[14] 的多孔可降解合金,降解速率達2~8 mm/y。當前鐵基生物可降解合金所面臨的最大難題是降解速率過慢,不能在治療周期內及時代謝移除,因此如何在保證合金力學可靠性的同時提高其降解速率,使其在體內完全降解的速度與組織修復的速度相匹配仍然需要進一步研究。
3 結論
本文設計制備了注射成形 Fe-xMn (x=25、30、35) 合金,研究了燒結時間對 Fe-Mn 合金中 Mn 的揮發損失以及顯微組織、力學性能、體外靜態降解性能的影響,主要結論如下:
1) 燒結時間對Fe-Mn合金的相組成無明顯影響,而Mn含量會影響合金的相組成,其中 Fe-35Mn合金主要由奧氏體組成;燒結過程中存在碳與氧的反應和Mn的揮發,Fe-35Mn合金氧含量維持在較低水平,Mn的揮發在試樣表面300~400μm區域內尤為明顯;Fe-Mn合金的致密度為90.8%~95.1%,平均晶粒度約為 10~20μm,兩者隨著燒結保溫時間延長而增加。
2) Fe-Mn合金抗拉強度隨著燒結保溫時間的延長 先增加后降低,伸長率隨Mn含量增加而逐漸增加,燒結時間為7h的Fe-35Mn 合金抗拉強度達358 MPa,伸長率達 10.83%。
3) 燒結7hFe-35Mn 合金降解速率達到1 mm/y,高于大多數其它方法制備的同類合金;隨著浸泡時間的延長,表層腐蝕產物的堆積會使合金的降解速率逐漸下降。
參考文獻
[1] LI Zijian, GU Xunan, LOU Siquan, et al. The development of binary Mg-Ca alloys for use as biodegradable materials within bone[J]. Biomaterials, 2008, 29(10): 1329−1344.
[2] SARAHE, HENDERSONA, KONSTANTIONSVB, et al. Magnesium alloys as a biomaterial for degradable craniofacial screws[J]. Acta Biomaterialia, 2014, 10(5): 2323−2332.
[3] YANG Hongtao, WANG Cong, LIU Chaoqiang, et al. Evolutionof the degradation mechanism of pure zinc stent in the one-year study of rabbit abdominal aorta model[J]. Biomaterials, 2017,145: 92−105.
[4] SCHRANZ D, ZARTNER P, MICHEL-BEHNKE I, et al. Bioabsorbable metal stents for percutaneous treatment of critical recoarctation of the aorta in a newborn[J]. Catheterization and Cardiovascular Interventions, 2010, 67(5): 671−673.
[5] 徐文利, 吳競堯, 譚麗麗, 等. 可降解鐵基心血管支架材料的研究進展[J]. 材料導報, 2012, 26(1): 75−78.
[6]GONG Haibo, WANG Kun, STRICH R, et al. In vitro biodegradation behavior, mechanical properties, and cytotoxicity of biodegradable Zn-Mg alloy[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2015, 103(8):1632−1640.
[7] PEUSTER M, WOHLSEIN P, EHLERDING M, et al. A novel approach to temporary stenting: degradable cardiovascular stents produced from corrodible metal-results 6- 18 months after implantation into New Zealand white rabbits[J]. Heart, 2001,86(5): 563−569.
[8] SCHINHAMMER M, HANZI A C, LOFFERR J F, et al. Design strategy for biodegradable Fe-based alloys for medical applications [J]. Acta Biomaterialia, 2010, 6(5): 1705−1713.
[9] LIU B, ZHENG Y F. Effects of alloying elements (Mn, Co, Al, W, Sn, B, C and S) on biodegradability and in vitro biocompatibility of pure iron [J]. Acta Biomaterialia, 2011, 7(3):1407−1420.
[10] HERMAWAN H, PURNAMA A, DUBE D, et al. Fe-Mn alloys for metallic biodegradable stents: degradation and cell viability studies[J]. Acta Biomaterialia, 2010, 6(5): 1852−1860.
[11]RABINKIN A. On magnetic contributions to γ→ε phase transformations in Fe-Mn alloys[J]. Calphad-Computer Coupling of Phase Diagrams & Thermochemistry, 1979, 3(2): 77−84.
[12] HERMAWAN H, ALAMDARI H, MANTOVANI D, et al. Iron-manganese: New class of metallic degradable biomaterials prepared by powder metallurgy[J]. Powder metallurgy, 2008, 51(1): 38−45.
[13] HERMAWAN H, PURNAMA A, DUBE D, et al. Fe-Mn alloys for metallic biodegradable stents: degradation and cell viability studies[J]. Acta Biomaterialia, 2010, 6(5): 1852− 1860.
[14] ZHANG Qian, CAO Peng. Degradable porous Fe-35wt.% Mn produced via powder sintering from NH4HCO3 porogen[J]. Materials Chemistry Physics, 2015, 163: 394−401.
[15] DRYNDA A, HASSEL T, BACH F W, et al. In vitro and in vivo corrosion properties of new iron-manganese alloys designed forcrdiovascular applications[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2015, 103(3): 649−660.
[16] LIU B, ZHENG Y F, RUAN Liquan. In vitro investigation of Fe30Mn6Si shape memory alloy as potential biodegradable metallic material[J]. Materials Letters, 2011, 65(3): 540−543.
[17]CAPEK J, KUbaseK J, DALIBOR V, et al. Microstructural, mechanical, corrosion and cytotoxicity characterization of the hot forged FeMn30(wt.%) alloy[J]. Materials Science & Engineering C, 2016, 58: 900−908.
[18] 舒暢, 蔡文武, 何昊, 等. 粉末冶金注射成型技術制備的新型血管內支架的動物應用研究[J ].中國普通外科雜, 2017, 26(2): 205−212.
[19] MARIOT P, LEEFLANG M A, SCHAEFFER L, et al. An investigation on the properties of injection-molded pure iron potentially for biodegradable stent application[J]. Powder Technology, 2016, 294: 226−235.
[20] HERMAWAN H, DUBE D, MANTOVANI D. Development of degradable Fe-35Mn alloy for biomedical application[J].Advanced Materials Research, 2007, 15/17: 107−112.
[21] HERMAWAN H, DUBE D, MANTOVANI D. Degradable metallic biomaterials: design and development of Fe-Mn alloys for stents[J]. Journal of Biomedical Materials Research Part A,2009, 93(1): 1−11.
[22] 曲選輝, 陳曉瑋, 章林, 等. 一種低氧含量的母合金法制備MIM418 合金的方法: 中國, 201611100809.7[p]. 2018−03−13.
[23] 李夢珊, 范景蓮, 劉濤, 等. Mn 含量對 Cu-Mn 合金結構與性能的影響[J]. 粉末冶金材料科學與工程, 2016, 21(4): 541−545.
[24] THIBON I, GUILLOU A, GLORIANT T. Interdiffusion in the FCC phase of Cu-Mn binary alloys[J]. Journal of Phase Equilibria & Diffusion, 2012, 33(4): 303−309.
[25]孔令種, 鄧志銀, 朱苗勇. 中高錳鋼在真空精煉過程中的氣化行為[J]. 特殊鋼, 2018, 39(4): 17−19.
[26] 侯少良. 真空感應熔煉中錳的揮發與控制[J]. 上海金屬, 1992,14(2): 60−61.
[27] 王信才. 功能材料 Fe-Mn 合金試制工藝研究[J]. 特鋼技術,2010, 16(1): 21−23.
[28] 李冬冬, 錢立和, 劉帥, 等. Mn 含量對 Fe-Mn-C 孿生誘發塑性鋼 拉伸變形行為 的 影 響[J]. 金屬學報 , 2018, 54(12):1777−1784.
[29] KURAMOTO S, FURUTA T, HWANG J H, et al. Plastic deformation in a multifunctional Ti-Nb-Ta-Zr-O alloy[J]. metallurgical & Materials Transactions A, 2006, 37(3): 657−662.
[30] BOWEN P K, SHEARIER E R, ZHAO S, et al. Biodegradable metals for cardiovascular stents: From clinical concerns to recent Zn‐alloys[J]. Advanced Healthcare Materials, 2016, 5(10):1121−1140.
[31] 李涵, 王燁欣, 崔振山, 等. 噴射成形制備 Fe-35Mn合金的體外降解行為及生物相容性[J]. 腐蝕科學與防護技術, 2018,30(3): 244−250.
[32] 陳連喜. 含鍶生物醫用鎂合金的性能及其應力腐蝕行為研究[D]. 廣州: 暨南大學, 2017: 1−129.
[33] 高家誠, 伍沙, 喬麗英, 等. 鎂及鎂合金在仿生體液中的腐蝕降解行為[J]. 中國組織工程研究與臨床康復, 2007, 18(2): 3584−3586.